Příklad nespontánní reakce je příkladem, kdy za daných podmínek není podporována tvorba produktu. Aby byla reakce nespontánní, musí být endotermická a doprovázená poklesem entropie.
Podívejme se na příklady níže -
Tání ledu příklady nespontánních reakcí
Tání ledu je nespontánní proces, protože v ledu jsou molekuly velmi dobře zabaleny, hlavním důvodem je přítomnost H – vazby, a proto má led nízkou entropii. Jak led taje, mezimolekulární síla se rozbije a také se přeruší řád, takže dojde k náhlé změně entropie. Hlavní podmínkou nespontánní reakce je, že dojde k náhlé změně entropie, takže reakce je považována za nespontánní.
2H2O → 2H2 + O2
Voda Vodík + kyslík
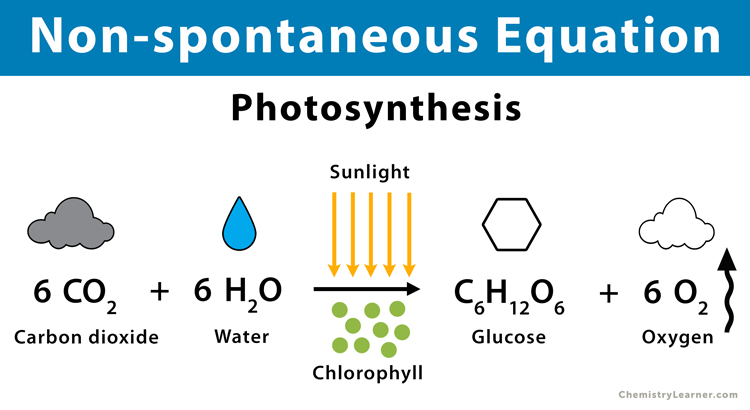
Reakce fotosyntézy
Protože se fotosyntéza skládá ze sledu nespontánních chemických procesů, jedná se o nerovnovážný systém. Celkový proces je endotermický (H > 0), s poklesem entropie systému (S < 0) a kladnou Gibbsovou volnou energií (G > 0).
Protože energie ze slunce nebo slunečního světla je absorbována během procesu fotosyntézy, nazývá se endotermická reakce.
6CO2 + 6H2O → C2H12O6 + 62
Oxid uhličitý + voda (chlorofyl) Glukóza Kyslík
Spalování metanu
Exotermické spalování organických molekul, jako je metan, je nespontánní proces. Ke spuštění procesu je zapotřebí plamen nebo jiskra. Z tohoto důvodu je spalování metanu nespontánní reakcí.
CH4 + H2O → CO2 + 2H2O
Metan + voda dává oxid uhličitý + voda
Naše atmosféra se skládá ze směsi dusíku a plynného kyslíku a tato reakce vytváří oxid dusný. Tato reakce je za normální teploty a tlaku nespontánní, je vysoce endotermická a dochází k mírně pozitivní změně.
- Tvorba oxidu dusnatého
- Naše atmosféra se skládá ze směsi dusíku a plynného kyslíku a tato reakce vytváří oxid dusný. Tato reakce není za normální teploty a tlaku spontánní, je vysoce endotermická a dochází k mírně pozitivní změně.
N2 + O2 → 2NE
Dusík Kyslík Oxid dusnatý
Elektrolýza vody:
Elektřina uvnitř tvaru energie je dodávána s vodou (H2O), který se rozkládá na vodík (H2) a kyslík (O2). Tento systém se nazývá elektrolýza a je a redoxní reakce
2 H2O (2) -> XNUMXH2 (g) + O2 (G)
Tvorba ozonu:
Přeměna kyslík (O2) na ozón (O3) je nespontánní metoda v jakémkoli ohledu na teploty. Je tlačen cestou ultrafialového (hν) mírného ze slunce.
3 O2 (g) + hv -> 23 (G)
Reakce elektrolytického článku
Zatímco elektrolytické články obsahují nespontánní reakce, a proto vyžadují externí zdroj elektronů, jako je stejnosměrná baterie nebo střídavý zdroj energie. Vzhledem k tomu, že z ní plují elektrony, anoda v elektrolytické molekule je kladná, zatímco katoda je hrozná, zatímco elektrony v ní cirkulují. V elektrolytické molekule se vnější napětí vede k tlaku na nespontánní reakci.
Přečtěte si více o na Vlastnosti peptidové vazby: Podrobná faktická a srovnávací analýza
Jak můžeme pochopit, zda je reakce nespontánní nebo ne?
Pokud je Gibbsova volná energie záporná, pak reakce je spontánní, a pokud je pozitivní, pak není okamžitý.
Význam nespontánní reakce
Spontánní technika je technika, která se jistě odehrává pod pozitivními podmínkami. Na druhé straně nespontánní technika se nyní již nebude přibližovat, dokud nebude „poháněna“ pomocí chronického vstupu elektřiny z vnějšího zdroje.
Pokud jsou H i S negativní, reakce je spontánní pouze při nízkých teplotách. Protože člen entropie je nižší kladná veličina při nízkých teplotách, je pravděpodobnější, že negativní entalpie řídí spontánnost reakce.
Ahoj… jmenuji se Niviya Rajan a dokončila jsem magisterské studium chemie. Vždy rád poznávám nové oblasti v oblasti chemie. Kromě toho ráda čtu a cestuji.

Ahoj kolego čtenáři,
Jsme malý tým v Techiescience, tvrdě pracujeme mezi velkými hráči. Pokud se vám líbí, co vidíte, sdílejte náš obsah na sociálních sítích. Vaše podpora znamená velký rozdíl. Děkuji!