V tomto článku je krátce diskutováno „Lewisova struktura kyseliny dusičné“, postup kreslení Lewisovy struktury, několik vlastností s několika podrobnými vysvětleními.
Kyselina dusičná je v podstatě iontová sloučenina skládající se z H+ a žádná3- ion. Dusík a kyslík mají 7 a 8 elektronů. Mezi nimi jsou pouze valenční elektrony znázorněny kolem příslušných atomů a zbytek elektronů se účastní tvorby kovalentní vazby.
Hlavním cílem tohoto článku je nakreslit a analyzovat strukturu Lewisovy tečky kyseliny dusičné uvedené níže.
Co je Lewisova struktura?
Lewisova struktura nebo známá jako struktura Lewisovy tečky je jedním z typů reprezentace jakékoli molekuly s elektrony valenčního obalu kolem příslušných druhů a vazbami připojenými k atomům.
Lewisova tečková struktura byl poprvé pojmenován podle jména významného vědce Gilberta. N. Lewis. Poprvé to představil Lewisova struktura koncept ve svém článku nazvaném „Atom a molekula“ v roce 1916.
Lewisova struktura ve skutečnosti pomáhá určit strukturu, počet elektronů účastnících se kovalentní vazby nebo tvorby, stejně jako elektrony zůstávají jako nevázané páry. Tyto všechny jsou zobrazeny v Lewisova struktura. Poskytuje také způsob, jak vypočítat formální náboj každého z atomů v konkrétním molekulárním druhu.
Proces kreslení Lewisovy struktury
Existují některé body, které je třeba dodržovat nakreslete Lewisovu strukturu které jsou vysvětleny níže -
- Nejprve budou vypočtena atomová čísla a také počet valenčních elektronů každého druhu.
- Počet elektronů k vyplnění oktetu nebo elektronů potřebných k vyplnění valenčního obalu tohoto druhu se počítá pro každý atom nakreslete Lewisovu strukturu.
- Měl by být také stanoven počet kovalentních nebo iontových vazeb přítomných v této molekule.
- Po stanovení výše uvedených parametrů budou nakresleny kosterní struktury molekuly zobrazující valenční obalové elektrony a vazby přítomné v molekule.

V tomto výše Lewisova struktura oxidu uhličitého, nevázané elektrony kyslíku jsou znázorněny kolem atomů kyslíku. Má jich celkem osm elektrony a elektronová konfigurace je 1s2 2s2 2p4. Celkový valenční elektron je šest. Z těchto šesti elektronů se dva elektrony účastní tvorby kovalentní vazby s uhlíkem. Zbytek čtyř elektronů je znázorněn jako nevázané elektrony kolem každého ze dvou atomů kyslíku.
Uhlík má atomové číslo šest elektronová konfigurace 1s2 2s2 2p2. Má tedy čtyři vnější nejvíce skořápkové elektrony a všechny valenční elektrony jsou použity k vytvoření čtyř kovalentní vazby se dvěma atomy kyslíku. Kolem atomů uhlíku tedy nejsou zobrazeny žádné elektrony.
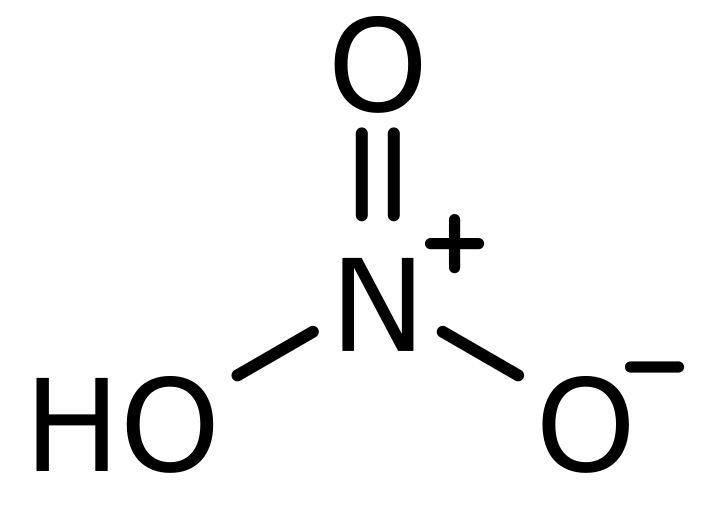
Lewisova struktura kyseliny dusičné
Kyselina dusičná, známá jako aqua fortis (anglicky znamená silná voda) je velmi silná anorganická kyselina molární hmotnost 63.012 g/mol a hustota 1.41 g/cm3. The Lewisova struktura kyseliny dusičné lze také čerpat pomocí metod vysvětlených výše.

Kyselina dusičná obsahuje tři typy atomů, vodík, kyslík a dusík. Kyslík a dusík mají osm a šest elektronů. Kyslík má celkem šest elektronů ve svém nejvzdálenějším obalu a dusík má pět elektronů ve svém nejzevnějším obalu.
Atomy kyslíku jsou označeny jako 1,2,3. Mezi těmito elektrony kyslík číslo 1 označoval jeho čtyři elektrony (mezi 8 valenčními elektrony) v kovalentní vazbě s dusíkem a vodíkem. Podobný případ je pozorován také u čísla 3 označovaného kyslíkem. Ale jiný scénář je pro číslo 2 označované jako kyslík. V tomto kyslíku je šest elektronů zobrazeno jako nevázaných kolem atomů kyslíku a stává se záporným.
Dusík má ve svém valenčním plášti pět elektronů a své čtyři z těchto pěti nejzevnějších elektronů využívá k vytvoření vazby se třemi atomy kyslíku a stává se +1.
Formální výpočet náboje kyseliny dusičné
Formální náboj každého atomu v celém molekulárním druhu lze vypočítat pomocí následujícího vzorce -
- Formální náboj = Celkový počet valenčních elektronů – počet elektronů, které zůstávají nevázané – (počet elektronů zapojených do tvorby vazby/2)
- Formální náboj na čísle 1 a čísle 3 značí kyslík = 6 – 4 – (4/2) = 0
- Formální náboj čísla 2 označovaný kyslíkem = 6 – 6 – (2/2) = -1
- Formální náboj na dusíku = 5 – 0 – (8/2) = +1
- Formální náboj vodíku = 1 – 0 – (2/2) = 0
Kredit: Wikimedia Commons
Často kladené otázky (FAQ)
Reaguje kyselina dusičná s vodou?
Odpověď: Kyselina dusičná se rozkládá na vodu, rozkládá se na oxid dusičitý (NO2), kyslík (O.2) a výsledný roztok získá nažloutlou barvu.
HNO3 = NE2 + O.2 + H2O
Reaguje kyselina dusičná s kovem?
Odpověď: Kyselina dusičná reaguje s kovem a uvolňuje plynný vodík (H2). Po reakci s kyselinou dusičnou tvoří hořčík (Mg) dusičnan hořečnatý [Mg (č3)2] a plynný vodík.
Mg + HNO3 = Mg (č3)2 + H2
Také čtení:
- Lewisova struktura kyseliny octové
- Na2so4 Lewisova struktura
- Seo2 Lewisova struktura
- Hio3 Lewisova struktura
- Hpo4 2 Lewisova struktura
- Lewisova struktura Brcl5
- Lewisova struktura Mg2
- Žádná Lewisova struktura
- Lewisova struktura Nh2f
- Al3 Lewisova struktura

Ahoj,
Jsem Aditi Ray, chemický MSP na této platformě. Absolvoval jsem promoci v oboru chemie na univerzitě v Kalkatě a postgraduální studium na Techno India University se specializací na anorganickou chemii. Jsem velmi rád, že jsem součástí rodiny Lambdageeks a rád bych toto téma vysvětlil zjednodušujícím způsobem.
Pojďme se připojit přes LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202

Ahoj kolego čtenáři,
Jsme malý tým v Techiescience, tvrdě pracujeme mezi velkými hráči. Pokud se vám líbí, co vidíte, sdílejte náš obsah na sociálních sítích. Vaše podpora znamená velký rozdíl. Děkuji!