Jak najít redoxní reakci

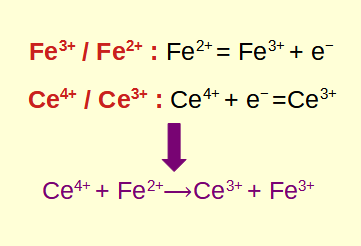

redoxní reakce, zkratka pro oxidačně-redukční reakce, jsou základní chemické procesy, které zahrnují přenos elektronů mezi reaktanty. Pochopení toho, jak identifikovat a vypočítat redoxní reakce, je klíčové v oblasti chemie a biologie. V tomto příspěvku na blogu prozkoumáme základy redoxních reakcí, naučíme se je identifikovat, ponoříme se do příslušných výpočtů a prozkoumáme jejich praktické aplikace.
Pochopení základů redoxních reakcí
Redoxní reakce nastávají, když dochází k přenosu elektronů mezi dvěma druhy. Jeden druh ztrácí elektrony (podléhá oxidaci), zatímco druhý druh elektrony získává (prochází redukci). Tento přenos elektronů je řízen rozdílem v elektronegativitě zúčastněných atomů.
Oxidovaný druh je známý jako redukční činidlo, protože daruje elektrony, zatímco redukovaný druh se nazývá oxidační činidlo, protože přijímá elektrony. Je důležité poznamenat, že redoxní reakce vždy zahrnují jak oxidaci, tak redukci, odtud název.
Význam redoxních reakcí
Redoxní reakce hrají zásadní roli v různých chemických a biologických procesech. Podílejí se na výrobě energie, korozi, syntéze chemikálií a dokonce i na fungování našeho vlastního těla. Například proces oxidativní fosforylace, ke kterému dochází v mitochondriích našich buněk, se opírá o redoxní reakce při produkci ATP, univerzální energetické měny buněk.
Běžné příklady redoxních reakcí
Podívejme se na některé běžné příklady redoxních reakcí:
Spalování: Když látka reaguje s kyslíkem za vzniku tepla a světla, jedná se o redoxní reakci. Například spalování dřeva nebo spalování benzínu v motoru auta.
Rezivění: Proces rezivění zahrnuje oxidaci železa v přítomnosti kyslíku a vody. Železo ztrácí elektrony a vytváří oxid železitý (rez).
Fotosyntéza: Během fotosyntézy rostliny přeměňují oxid uhličitý a vodu na glukózu a kyslík za pomoci slunečního záření. Tento proces zahrnuje redukci oxidu uhličitého a oxidaci vody.
Identifikace redoxních reakcí
Abychom identifikovali redoxní reakci, musíme rozpoznat látky, které procházejí oxidací a redukcí. Zde je několik klíčových kroků, které nám pomohou rychle identifikovat redoxní reakce:
Rozpoznání oxidace a redukce: Hledejte změny oxidačních stavů nebo úbytek/přírůstek elektronů. Zvyšuje-li se oxidační stav prvku, dochází k jeho oxidaci, zatímco snížení oxidačního stavu indikuje redukci.
Stanovení oxidačního čísla: Oxidační číslo je koncept používaný k určení distribuce elektronů ve sloučenině nebo iontu. Pomáhá nám identifikovat změnu oxidačních stavů během redoxní reakce.
Rychlá identifikace redoxních reakcí: Jednou z účinných metod k identifikaci redoxních reakcí je hledání přítomnosti určitých prvků nebo sloučenin, o kterých je známo, že podléhají redoxním reakcím. Například peroxid vodíku (H2O2) je běžné oxidační činidlo, zatímco látky jako borohydrid sodný (NaBH4) jsou redukční činidla.
Výpočet redoxních reakcí
Jakmile identifikujeme redoxní reakci, můžeme přistoupit k jejímu výpočtu. Zde je postup:
Nalezení polovičních reakcí: Rozdělte redoxní reakci na dvě poloviční reakce, z nichž jedna představuje oxidaci a druhá představuje redukci. To později pomáhá vyvážit rovnici.
Vyrovnání redoxní reakce: Vyrovnejte počet atomů na každé straně rovnice úpravou koeficientů. Při řešení redoxních reakcí je nezbytné vyvážit hmotnost i náboj.
Výpočet celkové redoxní reakce: Zkombinujte vyvážené poloviční reakce, abyste zajistili, že počet elektronů získaných při redukci odpovídá počtu elektronů ztracených při oxidaci.
Pokročilé koncepty redoxních reakcí
Abychom prohloubili naše chápání redoxních reakcí, pojďme prozkoumat některé pokročilé koncepty:
Stanovení spontánnosti redoxních reakcí: Spontánnost redoxní reakce lze určit pomocí konceptu redoxního potenciálu. Pokud je redoxní potenciál pozitivní, reakce je spontánní, což ukazuje na vyšší pravděpodobnost výskytu.
Nalezení koeficientu redoxních reakcí: Koeficienty ve vyvážené redoxní reakci představují relativní počet molů každého zúčastněného druhu. Tyto koeficienty jsou klíčové pro stechiometrické výpočty.
Pochopení role elektronů v redoxních reakcích: Elektrony jsou nositeli náboje v redoxních reakcích. Cestují z redukčního činidla do oxidačního činidla a usnadňují přenos energie.
Praktické aplikace redoxních reakcí
Redoxní reakce mají praktické aplikace v různých oblastech. Pojďme prozkoumat několik příkladů:
redoxní reakce v každodenním životě: Proces dýchání v našem těle závisí na redoxních reakcích, které přeměňují glukózu na energii. Baterie, které denně používáme, jako jsou alkalické baterie a lithium-iontové baterie, navíc fungují na základě redoxních reakcí.
Průmyslové aplikace redoxních reakcí: Redoxní reakce jsou klíčové v průmyslových procesech, jako je extrakce kovů, galvanické pokovování a čištění odpadních vod. Pomáhají odstraňovat škodlivé škodliviny a přeměňovat je na méně toxické látky.
redoxní reakce v biologických systémech: V lidském těle se redoxní reakce účastní různých biologických procesů, včetně metabolismu, detoxikace a imunitních reakcí. Nadměrné redoxní reakce však mohou vést k oxidativnímu stresu, který může poškodit buňky a přispět k nemocem.
Také čtení:
- Knoevenagelova reakce
- Příklad reakce závislé na světle
- Endotermická reakce
- Nukleofilní substituční reakce
- Příklad syntézní reakce
- Fotochemická reakce
- Příklad endergonické reakce
- Příklad reakce prvního řádu
- Příklad reakce nezávislé na světle
- Kolbeho reakce

Ahoj,
Jsem Aditi Ray, chemický MSP na této platformě. Absolvoval jsem promoci v oboru chemie na univerzitě v Kalkatě a postgraduální studium na Techno India University se specializací na anorganickou chemii. Jsem velmi rád, že jsem součástí rodiny Lambdageeks a rád bych toto téma vysvětlil zjednodušujícím způsobem.
Pojďme se připojit přes LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202

Ahoj kolego čtenáři,
Jsme malý tým v Techiescience, tvrdě pracujeme mezi velkými hráči. Pokud se vám líbí, co vidíte, sdílejte náš obsah na sociálních sítích. Vaše podpora znamená velký rozdíl. Děkuji!