Úroveň energie
- Úrovně elektronové skořápky nebo energie budou určené vzdálenosti od jádra atomu, kde by mohly být nalezeny elektrony, nebo nejvyšší pravděpodobnost, že budou nalezeny. Elektrony jsou záporně nabité částice v molekule, které se pohybují kolem pozitivního jádra, obvykle umístěného ve středu. Úrovně energie jsou něco jako míry skoků elektronů v daném kroku.
- Ve většině základních pojmů atomu; se skládají z elektronů obíhajících kolem jádra.
- Elektrony nejsou schopny zvolit žádnou dráhu podle svého přání. Elektrony jsou omezeny na oběžné dráhy pouze s určitou úrovní energie. Elektrony jsou schopné skákat pouze z jedné energetické úrovně nebo přejít na jinou úroveň. Elektrony nemohou obíhat s jinými energiemi, než jsou stanovené energetické úrovně.
Co je diagram energetické úrovně?
Prostředky energetické úrovně k vyhodnocení množství energie elektronů mohou vyžadovat a budou uvolněny během přechodu, pokud skočí z jedné oběžné dráhy na druhou. Základní nebo nulový stav je stav minimální energie vypočítaný pro H2 molekuly.

Jaké jsou čtyři energetické úrovně?
Existují čtyři typy orbitalů - s, p, d a f.
- Sharp-s
- Princip-p
- Difúzní
- Fundamentální-f
V atomu existuje několik jejich kombinací orbitaly.
Energetická úroveň je množství prostoru nebo oblastí kdekoli elektrony pravděpodobně bude přítomen. Tyto vzdálenosti, známé jako orbitaly, mají různé tvary, označené písmenem (s, p, d, f).

Geek 3, Atomové-orbitální-mraky spdf m0, CC BY-SA 4.0
Jak určíte energetické hladiny?

BruceBlaus, Úrovně elektronové energie Blausen 0342, CC BY 3.0
valenční elektrony
"Elektron, který je na nejvyšší energetické úrovni, se nazývá valenční elektron."
Základní stav
"Stav minimální energetické rovnováhy H."2 atom je uznáván jako základní stav. “
Vzrušený stav
Když má elektron (nebo atom) vyšší energii než tato nejnižší energie, říká se, že je v „vzrušeném stavu“.
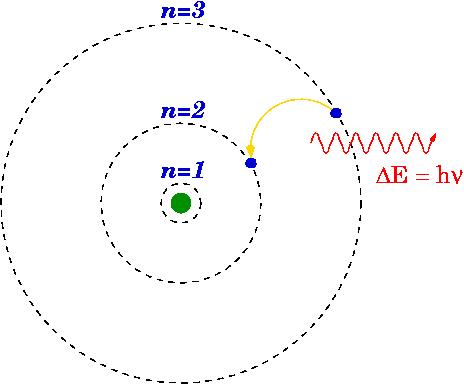
Pokud elektron klesne z vyšší úrovně na nižší, může foton vyzařovat nebo se uvolňovat energie.
Rozdíl energie
Energie emitovaného fotonu je rozdíl mezi energetickými hladinami primární (n i ) a konečné (n f ) Stát. Energie emitovaného fotonu se vypočítá pomocí Rydbergova vzorce.
Bohrův model vodíku
V roce 1913 Niels Bohr konceptualizoval energetické hladiny a spektrální frekvencin H.2 při zvažování různých jednoduchých předpokladů k opravě hypotetického klasického. Většina těchto nedostatků byla vyřešena modifikací Bohrova modelu Arnoldem Summerfieldem. Za tento model obdržel fyzik Niels Bohr Nobelovu cenu za fyziku v roce 1922.
V základním pojetí, že atom (Bohrův atomový model), elektrony rotují pouze určité oběžné dráhy kolem jádra. Kromě emise nebo absorpce energie dochází mezi povolenými oběžnými drahami k elektronům, které se pohybují dolů a nahoru.
Ačkoli tento základní model není dobře přijat, protože většina struktury atomů je komplikovanější než vodík, i když to vyžaduje nové předměty, proto zavedení kvantové mechaniky, v kvantové mechanice, je každý obíhající elektron vysvětlen matematickým výrazem známým jako vlnová funkce.
WillowW, Bohrův atomový model, CC BY-SA 3.0
Bohrův poloměr
"Bohrův poloměr (a0) je konstantní parametr, který se rovná nejpředvídatelnější vzdálenosti atomu vodíku mezi jádrem a elektronem v základním stavu (nerelativistický a s nekonečně těžkým protonem).""
Je pojmenována po Nielsovi Bohrovi kvůli jeho části v Bohrově modelu atomu.

SE3-29X, Vodík GIF, CC BY-SA 4.0
Spektrální čáry
Každá složka má určitou sadu energetických úrovní. Frekvence, ve kterých absorbuje a vyzařuje světlo, se tedy chovají jako jakýsi mikrofon, který identifikuje konkrétní sloučeninu a konkrétní látku. Tyto charakteristiky atomů poskytly výzkum u subjektů zvaných spektroskopie, vědy zaměřené na identifikaci molekul a atomů podle typu záření, které absorbují nebo emitují.
Série Balmer
Atomový fyzik Balmer analyticky zaznamenal vztah energií během uvolňování fotonů z atomu. Různé diskrétní fotonové energie / vlnové délky, které objevil Balmer, se nazývají Balmerova řada.
Později bylo známo, že energetické přechody vytvářejí Balmerovy linie z atomu vodíku. Atomův Bohrův model dokázal vysvětlit Balmerovu sérii, protože větší oběžné dráhy potřebovaly elektrony, aby měly podstatně více nepříznivé síly nebo negativní energie, aby se vyrovnaly s momentem hybnosti. Rydbergův vzorec má široký pohled na řadu Balmer pro všechny úpravy energetické úrovně.
Emisní spektrum
Projekt emisní spektrum atomového vodíku bylo rozděleno do mnoha spektrálních řad a vlnových délek poskytovaných standardním Rydbergovým vzorcem. Tyto detekované spektrální čáry jsou výsledkem přechodu elektronů z různých úrovní energie v atomu.
Emisní spektrum označuje různé vlnové délky emitované atomem nebo chemickou sloučeninou stimulovanou buď zahříváním, nebo elektrickým proudem. Emisní spektrum hořícího plynu nebo jiných molekul by mohlo být také použito pro příklad jeho složení.
Kredit: Ranjithsiji, Atomové emisní spektrum helia, CC BY-SA 4.0
Potenciální energie
"Toto je energie entity pro její polohu ve vztahu k jiným objektům, napětím, uloženému elektrickému náboji nebo jiným faktorům." v sobě. “
Vazebná energie
"Vazebná energie je minimální energie potřebná k udržení jádra pohromadě."
Ionizační energie
"Energetické množství, které izolovaný atom v základním elektronickém stavu potřeboval absorbovat, aby byl vybit jako e- “
Ionizační energie je popsána jako krok obtížnosti při odstraňování elektronu v atomu nebo iontu nebo schopnosti atomu nebo iontu vzdát se elektronu. K redukci elektronů obvykle nedochází v základním stavu druhu.
Ionizační energie se měří v kJ / mol, nebo množství energie, kterou vyžaduje, aby všechny atomy v molu uvolnily jednotu, resp.
Jak funguje ionizační energie?
Ionizační energie je energie potřebná, ve které by izolovaný plynný atom ze základního elektronového stavu měl absorbovat, aby uvolnil elektron. Čím více elektronů bude ztraceno, tím více bude tento iont kladný a bude obtížnější oddělit e- od atomu.
Jaký prvek má nejvyšší a nejnižší ionizační energii?
- Prvek, který má, má nejvyšší ionizační energii.
- Francium má minimální ionizační energii.
Ionizační energie prvku se zvětšuje zleva doprava v periodické tabulce a obecně klesá v periodické tabulce shora dolů.
Cdang a Adrignola, Ionizační energie periodická tabulka, CC BY-SA 3.0
Další informace o elektronovém mraku Klikněte zde
Také čtení:
- Je potenciální energie uložená energie
- Druhy kinetické energie
- Příklad přechodu elektrické energie na energii záření
- Příklad mechanické energie na elektrickou
- Gravitační energie na mechanickou energii
- Vzorec pro větrnou energii
- Ovlivňuje hmotnost potenciální energii
- Energie záření na chemickou energii
- Chemická energie na zvukovou energii
- Příklad kinetické energie na zvuk

Jsem Subrata, Ph.D. ve strojírenství, konkrétněji se zajímají o oblasti související s jadernou a energetickou vědou. Mám zkušenosti s více doménami od servisního technika pro elektronické pohony a mikrokontroléry až po specializovanou práci ve výzkumu a vývoji. Pracoval jsem na různých projektech, včetně jaderného štěpení, fúze se solární fotovoltaikou, konstrukce ohřívače a dalších projektů. Mám velký zájem o oblast vědy, energii, elektroniku a přístrojové vybavení a průmyslovou automatizaci, především kvůli široké škále stimulačních problémů zděděných v této oblasti a každý den se mění s průmyslovou poptávkou. Naším cílem je zde tyto nekonvenční a složité přírodovědné předměty snadno a srozumitelně doložit.

Ahoj kolego čtenáři,
Jsme malý tým v Techiescience, tvrdě pracujeme mezi velkými hráči. Pokud se vám líbí, co vidíte, sdílejte náš obsah na sociálních sítích. Vaše podpora znamená velký rozdíl. Děkuji!